Trypsín a chymotrypsín sú dva kľúčové enzýmy pri trávení proteínov v potrave. Obe sú produkované a vylučované ako zymogény, tj v inaktívnej forme, pankreasom; prekurzor zymogénu trypsínu sa nazýva trypsinogén, zatiaľ čo chymotrypsín sa nazýva chymotrypsinogén.
Trypsín a chymotrypsín patria do veľkej rodiny proteolytických enzýmov (podieľajúcich sa na trávení proteínov) a do podskupiny endopeptidázy. Tieto látky - vrátane žalúdočného pepsínu a pankreatickej elastázy - útočia na peptidové väzby v rámci aminokyselinového reťazca, čím vznikajú menšie molekulárne fragmenty. Enzýmy patriace do druhej skupiny, ktoré tvoria exopeptidázy, dokončujú prácu trypsínu a chymotrypsínu, pričom oddeľujú jednotlivé aminokyseliny od koncov peptidového reťazca; Pankreatické karboxypeptidázy (A1, A2 a B, ktoré napadajú karboxylový koniec) patria do tejto rodiny, ale tiež aminopeptidázy (ktoré napádajú aminoterminálny koniec) a dipeptidázy, ktoré sú produkované a vylučované sliznicou tenkého čreva. Niektoré karboxypeptidázy, podobné tým, ktoré boli pozorované pre trypsín (trypsinogén) a chymotrypsín (chymotrypsinogén), sú vylučované pankreasom v inaktívnej forme. Vo všetkých troch prípadoch je enzýmom zapojeným do procesu enzymatickej aktivácie enteropeptidáza, proteín produkovaný a vylučovaný bunkami duodenálnej sliznice; špecifickejšie je enteropeptidáza špecifická pre trypsinogén, ktorý po premene na trypsín tiež aktivuje ďalšie proteolytické enzýmy, vrátane samotného trypsinogénu.
Funkčné rozdiely medzi trypsínom a chymotrypsínom sa jednoducho týkajú ich špecifickosti, tj schopnosti rozpoznávať a rozkladať len väzby vytvorené dobre definovanými aminokyselinami. Trypsín zasahuje hlavne do peptidových väzieb, ktoré zaberajú bázické aminokyseliny (ako je arginín a lyzín), zatiaľ čo chymotrypsín hydrolyzuje hlavne väzby zahŕňajúce tyrozín, fenylalanín, tryptofán, leucín a metionín.
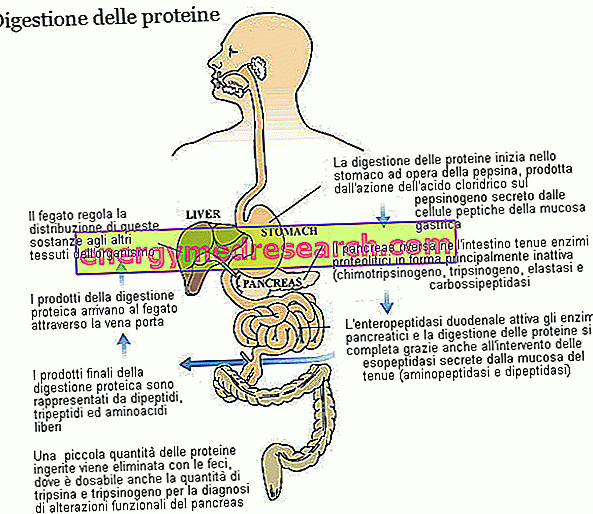
Vďaka rôznym proteolytickým enzýmom, s prispením žalúdočnej kyslosti, sú diétne proteíny - pôvodne tvorené niekoľkými desiatkami aminokyselín - rozdelené na dipeptidy, tripeptidy a voľné aminokyseliny, všetky ľahko absorbovateľné látky, ktoré pochádzajú z kapilár črevnej sliznice. transportované do pečene.
Trypsín a chymotrypsín v stolici
Stanovenie chymotrypsínu a trypsínu v stolici sa používa, a to najmä v minulosti, ako nepriamy test funkčnej kapacity exokrinného pankreasu. Ak niečo nefunguje správne na tejto úrovni žľazy, je logické očakávať zníženú syntézu trypsínu a chymotrypsínu, ktorá bude tiež nedostatočná v stolici. Test má dobrú citlivosť, ale je zaťažený skutočným rizikom falošných pozitív a falošných negatív. Použitie laxatív napríklad znižuje koncentráciu enzýmov vo výkalovom materiáli, zatiaľ čo príjem tráviacich extraktov pankreasu (ako pankreatín) alebo zeleniny (napr. Stonky ananásu, papája, papaín a spôsobujú falošne negatívne výsledky. Tiež črevná bakteriálna flóra mierne ovplyvňuje množstvo trypsínu a chymotrypsínu, ktoré sa dostávajú do stolice nezmenené; z tohto dôvodu môže použitie antibiotík viesť k falošným negatívam; naopak, v prítomnosti divertikulózy a iných stavov, ktoré podporujú proliferáciu baktérií, môžu byť zaznamenané falošne pozitívne výsledky.
Klasickou aplikáciou trypsínu a chymotrypsínu v stolici je detekcia pankreatickej insuficiencie u pacientov s cystickou fibrózou. Jedným z dôsledkov tohto ochorenia je narušenie normálneho transportu trypsínu a iných tráviacich enzýmov z pankreasu do dvanástnika; Z tohto dôvodu sú pri narodení výkaly dieťaťa s cystickou fibrózou obzvlášť kompaktné, až do tej miery, že spôsobujú črevnú obštrukciu. V dôsledku toho sa zaznamenali v maconium zvlášť malé množstvá chymotrypsínu a trypsínu.



